第3课时 氧化还原反应的规律和应用
学习目标
1.了解氧化性、还原性强弱的比较;
2.了解氧化还原反应的规律并能利用其解决问题。
3.掌握氧化还原反应方程式的配平方法;
4.能够根据给出信息,正确书写氧化还原反应方程式。
知识导学
一.对氧化性、还原性强弱的认识
1.氧化性指物质 得电子 的性质(或能力);
还原性指物质 失电子 的性质(或能力)。
2.虽然:Na-e-===Na+,Al-3e-===Al3+,但是还原性:Na > Al
原因:根据金属活动性顺序,Na比Al活泼,因为Na更易失去电子,所以Na比Al的还原性强。
氧化性、还原性的强弱取决于 物质得、失电子的难易程度 ,与 得、失电子数目的多少 无关。
3.从元素的价态考虑:
(1)最高价态——只有 氧化性 如H2SO4中的S、KMnO4中的Mn等;
(2)最低价态——只有 还原性 ,如金属单质、Cl-、S2-等;
(3)中间价态——既有 氧化性 ,又有 还原性 ,如Fe2+、S、Cl2等。
二.氧化性、还原性强弱的比较方法
1.依据氧化还原反应原理判断
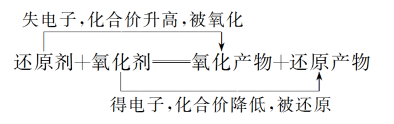
(1)氧化性强弱: 氧化剂>氧化产物
(2)还原性强弱: 还原剂>还原产物
【例题1】 反应① H2SO3+I2+H2O===2HI+H2SO4
反应② 2FeCl3+2HI===2FeCl2+I2+2HCl
请判断:H2SO3、I-、Fe2+三者还原性的强弱;Fe3+、I2、H2SO4三者氧化性的强弱。
【答案】还原性:H2SO3>I->Fe2+;氧化性:Fe3+>I2>H2SO4。
2.依据元素活动性顺序判断
(1)金属越活泼,其单质的还原性越强,对应阳离子的氧化性逐渐减弱。

(2)非金属越活泼,其单质氧化性越强,对应阴离子的还原性越弱。
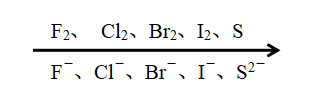
由左至右,非金属单质的氧化性逐渐 减弱 ;
F-、Cl-、Br-、I-、S2-,由左至右,阴离子的还原性逐渐 增强 。
3.依据产物中元素价态的高低判断
(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性 强 。例如:
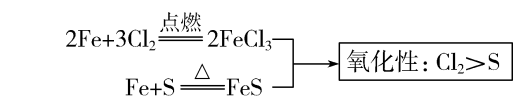
(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性 强 。例如:
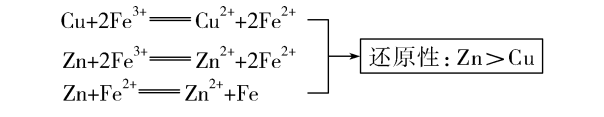
4.依据影响因素判断
(1)浓度:同一种物质,浓度越大,氧化性(或还原性)越 强 。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越 强 。如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化(还原)性越强。
如氧化性:KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
三.氧化还原反应的规律
1.价态规律
(1)价态归中规律
含同种元素但价态不同的物质间发生氧化还原反应时,该元素价态的变化一定遵循
“高价+低价 中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。称为价态归中反应。
例如:不同价态硫之间可以发生的氧化还原反应是下图中的①②③④。
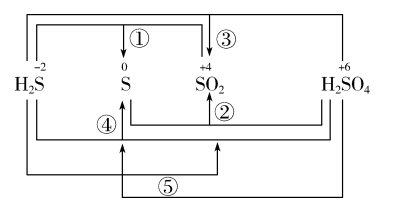
【注意】 不会出现⑤中H2S转化为SO2,而H2SO4转化为S的情况,出现了交叉。
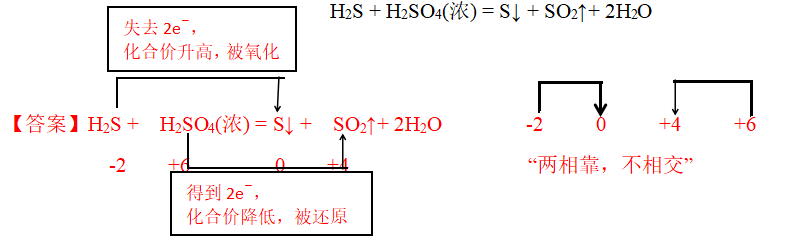
【例题2】 请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。
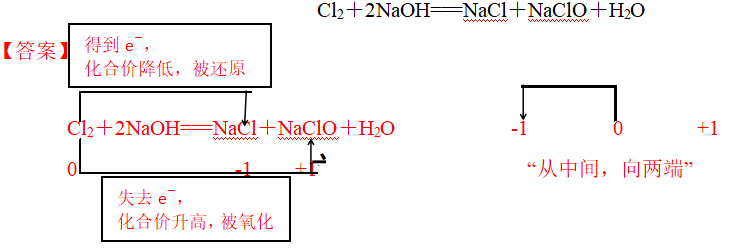
(2)歧化反应规律
物质所含元素能生成多种价态的产物时,发生的氧化还原反应称为歧化反应。
“中间价 高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。
【例题3】请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。
2.强弱规律
根据氧化还原反应反应原理:
(1)氧化性强弱: 氧化剂>氧化产物
(2)还原性强弱: 还原剂>还原产物
依据物质氧化性或还原性的强弱,也能判断一个氧化还原反应是否符合反应原理,能否自发进行。【例题4】已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:
Fe2+<H2O2<I-<SO2,则下列反应不能发生的是 ( )
A.2Fe3++SO2+2H2O===2Fe2++SO4(2-)+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++H2O2===2Fe2++O2↑+2H+
【答案】C
3.先后规律
同一体系中,当有多个氧化还原反应发生时,强者优先,总是氧化性强(还原性强)的物质优先反应。
例如:(1)向含相同物质的量浓度的S2-、I-、Br-溶液中,缓慢通入氯气,
还原性强的离子优先发生反应,先后顺序为 S2-、I-、Br- ;
(2)向含等物质的量浓度的Fe3+、Cu2+、H+、Ag+溶液中,缓慢加入足量的铁粉,
氧化性强的离子优先发生反应,先后顺序为 Ag+、Fe3+、Cu2+、H+ 。
4.守恒规律
特征:氧化还原反应中,化合价有升必有降,升降总值 相等 。
本质:氧化还原反应中,氧化剂得电子总数 等于 还原剂失电子总数。
应用:氧化还原反应方程式的配平;有关得失电子数目的计算。
【例题5】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO 被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为 ( )
A.2 B.5
C.4 D.3
【答案】B
【总结】守恒法解题思路
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物。
(2)找准一个原子或离子得失电子数(注意化学式中粒子的个数)。
(3)根据题中物质的物质的量和得失电子守恒列出等式。
n(氧化剂)×变价原子个数×化合价变化值(高价-低价)=
n(还原剂)×变价原子个数×化合价变化值(高价-低价)
(4)如果反应涉及多步时,要理清反应过程,抓住整个过程中最终得失电子的物质,利用得失电子守恒解题,会更快捷。
【知识进阶】
一.氧化还原反应方程式的配平方法
1.基本原则
(1)得失电子守恒
特征:氧化还原反应中,化合价有升必有降,升降总值 相等 。
本质:氧化还原反应中,氧化剂得电子总数 等于 还原剂失电子总数。
(2)质量守恒
反应前后原子的 种类 和 数目 不变。
(3)电荷守恒
对于离子反应,方程式两端阴、阳离子所带电荷总数相等。
2.一般步骤
(1)标变价,标明反应前后变价元素的化合价;
(2)列得失,列出化合价的变化值;
(3)求总数,求最小公倍数使化合价升降总数相等;
(4)配系数,确定氧化剂、还原剂或氧化产物、还原产物的化学计量系数,观察法配平其它物质系数;
(5)查守恒,检查质量、电荷、得失电子是否守恒。